| |
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительными (ОВР) называются реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ. Под степенью окисления (О) понимают стехиометрическую валентность со знаком (+) или (-). Знак (+) приписывают более электроположительному элементу (металлу), а (–) более электроотрицательному (неметаллу). Окисление-восстановление - это единый, взаимосвязанный процесс.
Окисление соответствует увеличению степени окисления элемента, а восстановление - ее уменьшению.
Степень окисления простых ионов совпадает с их зарядом: Fe3+, K+, Cl— и т. д. Степень окисления сложного нона совпадает с его зарядом (NH4+), (SO42—), (PO43—) и. т. д.
Степень окисления атома внутри сложного иона или молекулы прямо не связана с зарядом на этом атоме. Например, заряд атома Сr в молекулах CrCl2, CrCl3, K2CrO4 равен 1,9; 1,3 и 0,2 заряда электрона (со знаком ‘+‘), а степени окисления - +2, +3 и +6 соответственно. Нахождение степени окисления основывается на следующем правиле: сумма степеней окисления атомов в молекуле равна нулю, а в сложном ионе равна заряду этого иона. Атом, находящийся в высшей степени окисления, может быть только окислителем, если он находится в низшей степени окисления - только восстановителем, а если он обладает промежуточной степенью окисления, то может быть и окислителем и восстановителем. Например: N+5 (HNO3), S+6 (H2SO4) — проявляют только окислительные свойства (высшая степень окисления); N+4 (NO2), S+4 (SO2) — проявляют окислительные и восстановительные свойства (промежуточные степени окисления);
N-3 (NH3), S-2 (H2S) — проявляют только восстановительные свойства (низшие степени окисления).
Для реакций окисления-восстановления применяют два метода составления уравнений: метод баланса степеней окисления и метод полуреакций.
Метод баланса степеней окисления.
При этом методе для нахождения коэффициентов учитывают правило, согласно которому общее изменение степеней окисления в реакции равно нулю, то есть повышение степени окисления восстановителя равно ее понижению у окислителя.
Пример 1. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме:

Решение.
Вычисляем, как изменяют свою степень окисления восстановитель и окислитель, и отражаем это в уравнениях:
Уравнения электронного баланса:

Изменение степеней окисления (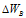 ) восстановителя должно быть равно изменению степени окисления ( ) восстановителя должно быть равно изменению степени окисления (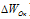 ) окислителя, Общее наименьшее кратное для изменения степеней окисления ) окислителя, Общее наименьшее кратное для изменения степеней окисления 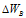 и и 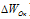 равно десяти. Разделив это число на 5, получим коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Коэффициенты перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Уравнение реакции будет иметь вид: равно десяти. Разделив это число на 5, получим коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Коэффициенты перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Уравнение реакции будет иметь вид:
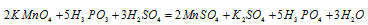
В данной реакции окислителем является KMnO4, в котором атом марганца уменьшает свою степень окисленности от +7 до +2, а восстановителем является Н3PO3, в котором фосфор увеличивает свою степень окисленности от +3 до +5. Таким образом, атомы, изменяющие свои степени окисленности, находятся в молекулах разных веществ, значит, данная реакция относится к реакциям межмолекулярного окисления-восстановления.
Пример 2. Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, принимая максимальное восстановление последней.
Решение.
Цинк (как любой металл) проявляет только восстановительные свойства. В концентрированной серной кислоте окислительную функцию несет сера (+6). Максимальное восстановление серы означает, что она приобретает минимальную степень окисления. Минимальная степень окисления серы как р- элемента VI А группы равна -2. Цинк как металл II В группы имеет постоянную степень окисления +2. Отражаем сказанное в уравнениях:
Уравнения электронного баланса:

Составляем уравнение реакции:
4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
Перед H2SO4 стоит коэффициент 5, а не 1, так как четыре молекулы кислоты идут на связывание четырех ионов Zn2+ (то есть H2SO4 - и окислитель, и среда реакции).
При повышении степени окисления протекает процесс окисления, а само вещество является восстановителем. При понижении степени окисления протекает процесс восстановления, а само вещество является окислителем.
Далее по балансу атомов водорода определяют число молей воды, Для проверки правильности подобранных коэффициентов подсчитывают баланс кислорода.
В данной реакции окислителем является H2SO4, в котором атом серы уменьшает свою степень окисленности от +6 до -2, а восстановителем является Zn, в котором он увеличивает свою степень окисленности от 0 до +2. Таким образом, атомы, изменяющие свои степени окисленности, находятся в молекулах разных веществ, значит, данная реакция относится к реакциям межмолекулярного окисления-восстановления.
Метод полуреакций.
В тех случаях, когда реакция протекает в водном растворе (расплаве), при составлении уравнений исходят не из изменения степени окисления атомов, входящих в состав реагирующих веществ, а учитывают форму существования веществ в растворе (простой или сложный ион, атом или молекула нерастворенного или слабодиссоциирующего в воде вещества). В этом случае при составлении ионных уравнений окислительно- восстановительных реакций следует придерживаться той же формы записи, которая принята для ионных уравнений обменного характера, а именно: малорастворимые, малодиссоциированные и газообразные соединения следует писать в молекулярной форме, а ноны, не изменяющие своего состояния, - исключать из уравнения.
Метод полуреакций точнее отражает истинные изменения веществ в процессе окислительно-восстановительных реакций и облегчает составление уравнений этих процессов в ионно-молекулярной форме.
Поскольку из одних и тех же реагентов могут быть получены разные продукты в зависимости от характера среды (кислотного, щелочного, нейтрального) для таких реакций в ионной схеме кроме частиц, выполняющих функции окислителя и восстановителя, обязательно указывается частица, характеризующая реакцию среды (то есть ионы Н+ или ион ОН—, или молекула Н20).
Пример 3. Используя метод полуреакций, расставьте коэффициенты в реакции:
КMnO4 + КNO2 + Н2SO4 → МnSO4 + KNO2 + K2SO4 + Н2O.
Решение.
Записываем реакцию в ионном виде:
MnO4— + NO2— + 2H+ → Mn2+ + NO3— + Н20
K+ и SO42— остаются без изменения, поэтому в ионной схеме их не указывают). Из ионной схемы видно, что перманганат-ион MnO4— превращается в Мn2+ и при этом освобождаются четыре частицы кислорода.
В кислой среде каждая освобождающаяся частица кислорода связывается с
2H+ с образованием молекулы воды.
Отсюда следует: MnO4— + 8Н+ → Mn2+ + 4Н20.
Находим разницу зарядов  = (+2)-(+7) = -5 (знак ‘-‘ показывает, что протекает процесс восстановления). = (+2)-(+7) = -5 (знак ‘-‘ показывает, что протекает процесс восстановления).
Для второго процесса, превращения NO2— в NO3—, недостающий кислород берется из воды, и в результате образуется избыток ионов H+:
NO2— + Н20;  = NO3— + 2H+ = 1-(-1) = 2 (знак ‘+‘ показывает, что протекает процесс окисления). = NO3— + 2H+ = 1-(-1) = 2 (знак ‘+‘ показывает, что протекает процесс окисления).
Таким образом, получаем:
Уравнения ионно-молекулярного баланса:
Восстановитель2 MnO4— + 8Н+ —5 MnO4— + 8Н+ —5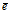 → Mn+2 + 4Н20; → Mn+2 + 4Н20;  = -5 окисление; = -5 окисление;
Окислитель5 NO2— + Н20 + 2 NO2— + Н20 + 2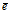 → NO3— + 2H+; → NO3— + 2H+; = 2 восстановление. = 2 восстановление.
Умножая члены первого уравнения на 2. а второго - на 5 и складывая их, получим ионно-молекулярное уравнение данной реакции:
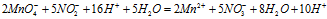
Сократив одинаковые частицы в левой и правой части уравнения, получаем окончательно ионно-молекулярное уравнение:
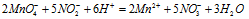
По ионному уравнению составляем молекулярное уравнение:
2KMnO4 + 5KNO2 + 3H2SO4 → 2MnSO4 + 5KNO3 + K2SO4 + 3H2O.
В щелочной и нейтральных средах можно руководствоваться следующими правилами.
В щелочной среде каждая освобождающаяся частица кислорода соединяется с одной молекулой воды, образуя два гидроксид-иона (2ОН—), а каждая недостающая - берется из 2ОН— - ионов с образованием одной молекулы воды.
В нейтральной среде каждая освобождающаяся частица кислорода соединяется с одной молекулой Н20, образуя 2ОН— - нона, а каждая недостающая берется из воды с освобождением двух ионов водорода (2Н+).
Если в окислительно-восстановительной реакции участвует перекись водорода (Н2О2), надо учитывать роль Н2О2 в конкретной реакции. В Н2О2 кислород находится в промежуточной степени окисления (-1), поэтому перекись водорода в окислительно-восстановительных реакциях проявляет окислительно-восстановительную двойственность. В тех случаях, когда Н2О2 является окислителем, полуреакции имеют следующий вид:
Н2О2 + 2H+ —2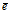 → 2H2O; → 2H2O;  = -2 (кислая среда); = -2 (кислая среда);
Н2О2 —2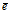 → 2OH—; → 2OH—;  = -2 (нейтральная и щелочная среда). = -2 (нейтральная и щелочная среда).
Если перекись водорода является восстановителем:
Н2О2 + 2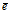 → O2 + 2H+; → O2 + 2H+;  = +2 (кислая среда); = +2 (кислая среда);
Н2О2 + 2ОН— + 2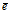 → O2 + 2H2O; → O2 + 2H2O;  = +2 (нейтральная и щелочная среда). = +2 (нейтральная и щелочная среда).
Типы окислительно-восстановительных реакций.
Различают три типа окислительно-восстановительных реакций:
1. Межмолекулярные окислительно-восстановительные реакции, при которых изменяются степени окисления атомов элементов, входящих в состав разных веществ. Реакции, рассмотренные в примерах 1-3, относится к этому типу. Например:
Пример 4. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме:
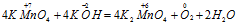
Решение.
Составляем уравнения ионно-молекулярного баланса, получим:
Восстановитель 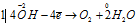 процесс окисления; процесс окисления;
Окислитель 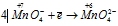 процесс восстановления. процесс восстановления.
В данной реакции окислителем является KMnO4, в котором атом марганца уменьшает свою степень окисленности от +7 до +6, а восстановителем является КОН, в котором кислород увеличивает свою степень окисленности от -2 до 0. Таким образом, атомы, изменяющие свои степени окисленности, находятся в молекулах разных веществ, значит, данная реакция относится к реакциям межмолекулярного окисления-восстановления.
2. Реакции самоокисления-самовосстановления (диспропорционирования, дисмутации).
В этом случае степень окисления одного и того же элемента и повышается, и понижается. Реакции диспропорционировация характерны для соединений или элементов веществ, соответствующих одной из промежуточных степеней окисления элемента. Например:
Пример 5. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме:
Решение.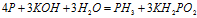
Уравнения электронного баланса:
Восстановитель 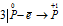 процесс окисления; процесс окисления;
Окислитель 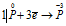 процесс восстановления процесс восстановления
Данная реакция относится к реакции диспропорционирования, потому что сопровождается одновременным увеличением и уменьшением степени окисленности атомов одного и того же элемента (фосфора), находящегося в одном веществе (Р).
Пример 6. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме:
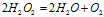
Решение.
Уравнения электронного баланса:
Восстановитель 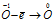 процесс окисления; процесс окисления;
Окислитель 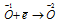 процесс восстановления. процесс восстановления.
Данная реакция относится к реакции диспропорционирования, потому что сопровождается одновременным увеличением и уменьшением степени окисленности атомов одного и того же элемента (кислорода), находящегося в одном веществе (пероксид водорода Н2О2).
3. Реакции внутримолекулярного окисления-восстановления, при котором происходит выравнивание степеней окисленности атомов элемента, находящихся в одном и том же веществе, называется внутримолекулярным окислением-восстановлением (реакция конпропорционирования). Например:
Пример 7. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме:
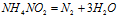
Решение.
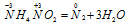
Уравнения ионно-молекулярного баланса:
Восстановитель 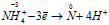 процесс окисления; процесс окисления;
Окислитель 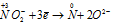 процесс восстановления процесс восстановления
В данной реакции атомы азота, находящиеся в нитрите аммония NH4NO2, изменяют свои степени окисленности один с -3 до 0, другой с +3 до 0. Процесс, в результате которого происходит выравнивание степеней окисленности атомов элемента, находящихся в одном и том же веществе, называется внутримолекулярным окислением-восстановлением (реакция конпропорционирования).
|
 |
