ЭЛЕКТРОЛИЗ
Электролизом называют окислительно-восстановительные реакции, проходящие на электродах при пропускании постоянного электрического тока через раствор или расплав электролита. На отрицательном электроде (катоде) происходит процесс восстановления, на положительном (аноде) — процесс окисления.
1. Электролиз расплава соли (на примере КаСl).
При расплавлении электролит диссоциирует на ионы:
NaCl → Na+ + Cl–
На катоде происходит восстановление ионов Na+:
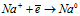
На аноде - окисление ионов Cl–:
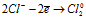
Уравниваем число электронов:
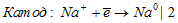
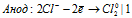
Суммарный процесс:
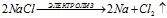
2. Электролиз водных растворов.
В растворах электролитов помимо ионов, образуемых электролитами, имеются ионы, образующиеся в результате диссоциации воды:
H2O ↔ H+ + OH–
которые также могут принимать участие в электролизе.
Легкость восстановления катионов на катоде соответствует ряду активности металлов. Чем правее в этом ряду находится металл, тем легче идет его восстановление. Если металл находится левее водорода в ряду активности, то происходит также восстановление ионов водорода из воды, если же металл находится левее алюминия, то он в водном растворе восстановлен быть не может — идет только восстановление воды.
На аноде происходит окисление анионов. По уменьшению легкости их окисления они располагаются в следующий ряд: I–, Вг–, S2–, Сl–, ОН–, анионы кислородосодержащих кислот. Поэтому в водных растворах в первую очередь происходит окисление ионов галогенов или серы, а если их нет, то про-исходит окисление ионов гидроксила из воды до кислорода:
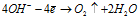
или
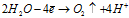
Примеры электролиза водных растворов:
1). NaCl:
NaCl ↔ Na+ + Cl–;
H2O ↔ H+ + OH–
Катод: 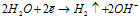
Анод: 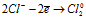
Суммарный процесс: 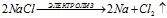
2). CuCl2:
CuCl2 ↔ Cu2+ + 2Cl–;
H2O ↔ H+ + OH–
Катод: 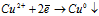
Анод: 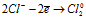
Суммарный процесс: 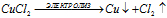
3). CuSO4:
CuSO4 ↔ Cu2+ + SO42–;
H2O ↔ H+ + OH–
Катод: 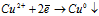
Анод: 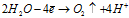
Суммарный процесс: 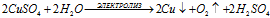
4). NiSO4:
NiSO4 ↔ Ni2+ + SO42–;
H2O ↔ H+ + OH–
Катод:a) 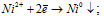
б) 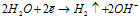
эти два процесса идут одновременно и независимо друг от друга. Соотношение между ними зависит от соотношения концентраций ионов никеля и ионов водорода, а также от напряжения и силы тока. Объясняется это тем, что никель – металл средней активности, его электродный потенциал имеет незначительное отрицательное значение (-0,25 В), как и потенциал водородного электрода (-0,41 В). Поэтому продуктами электролиза будут металлический никель и газообразный водород. При электролизе раствора сульфата никеля протекают процессы восстановления ионов Ni2+ и молекул H2O. Сначала преимущественно идет процесс восстановления ионов никеля, но затем концентрация ионов никеля в растворе уменьшается, а концентрация ионов водорода увеличивается и усиливается интенсивность процесса восстановления воды.
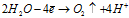
Суммарный процесс: 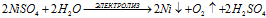
5). NaOH, KOH, H4SO4, NaSO4, K2SO4 — в этих случаях идет только электролиз воды:
Катод: 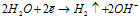
Анод: 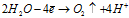
Суммарный процесс: 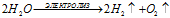
При этом на электродах будут выделяться газы, на катоде водород, а на аноде - кислород.
|
